Detección de SARS-CoV-2 por RT-qPCR en muestras agrupadas de personal y pacientes en hospitales de Sonora, México
DOI:
https://doi.org/10.18633/biotecnia.v27.2434Palabras clave:
COVID-19, SARS-Cov2, RNA PoolResumen
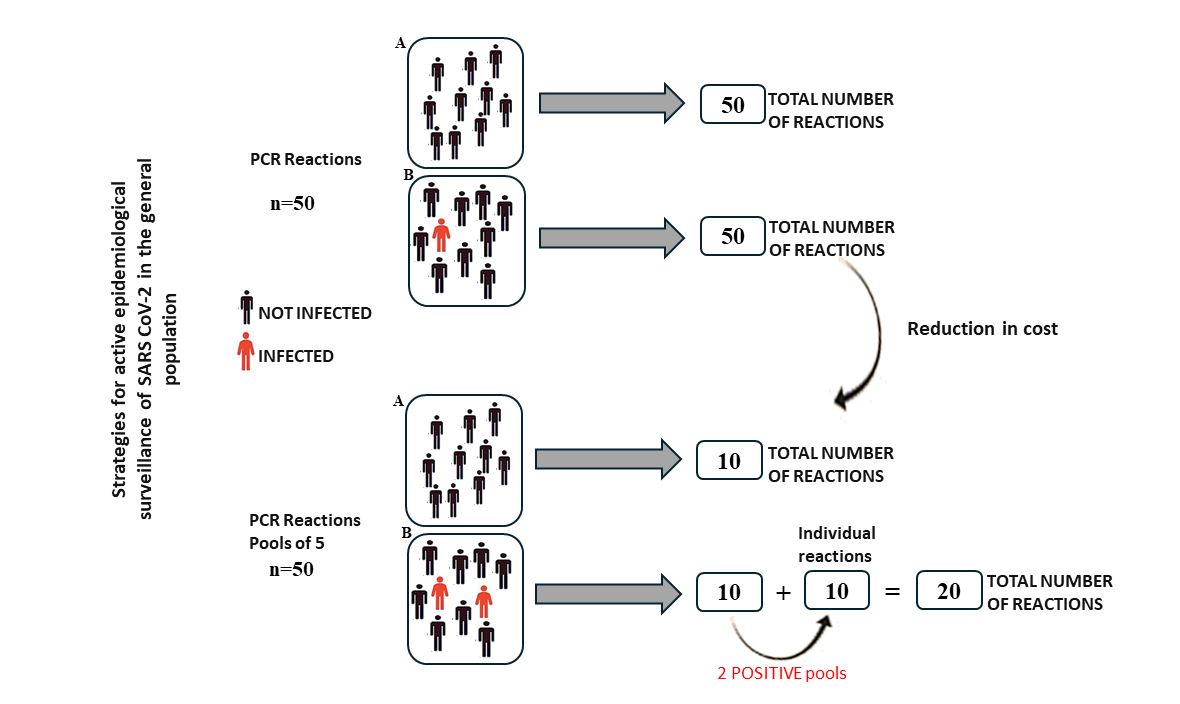
El método de RT-qPCR es altamente confiable para detectar el SARS-CoV-2, pero su costo dificulta su uso generalizado en cribados a gran escala. Este estudio tuvo como objetivo evaluar y validar protocolos alternativos rentables para pruebas masivas en entornos de baja morbilidad pero alto riesgo. Se analizaron 50 muestras de pacientes del área de cuidados intensivos de COVID y 50 muestras del personal de HGE utilizando un enfoque de agrupación en diferentes configuraciones de prevalencia. El ARN individual se agrupó en grupos de cinco, luego se probó para SARS-CoV-2 mediante RT-qPCR. Esta estrategia de agrupación se utilizó para diagnosticar SARS-CoV-2 en personal médico, involucrando 885 muestras de personal de HGE y 100 de HIES durante el pico de la pandemia. Se observaron reducciones significativas en el número de reacciones de RT-qPCR: una disminución del 77 % en el costo de análisis para las 885 muestras del personal de HGE, y una reducción del 80 % en las reacciones necesarias para las 100 muestras del personal de HIES. Este estudio demostró la efectividad y eficiencia del análisis de muestras agrupadas para el diagnóstico generalizado de SARS-CoV-2 en población de bajo riesgo pero con alta exposición. Este enfoque puede implementarse en entornos con alta densidad espaciotemporal para mitigar los riesgos de transmisión hospitalaria.
Descargas
Citas
Abdalhamid, B. et. al., 2020. Assessment of Specimen Pooling to Conserve SARS CoV-2 Testing Resources. American Journal of Clinical Pathology, June. 153(6).
Alcoba-Florez, J. et. al., 2021. Increasing SARS-CoV-2 RT-qPCR testing capacity by sample pooling. International Journal of Infectious Diseases, February. Volumen 103.
Bai, Y. et. al., 2020. Presumed Asymptomatic Carrier Transmission of COVID-19. Journal of American Medical Asociation, February. 323(14).
Barat, B. et. al., 2021. Pooled Saliva Specimens for SARS-CoV-2 Testing. Journal of clinical Microbiology, February.
Ben-Ami, R. et. al., 2020. Large-scale implementation of pooled RNA extraction and RT-PCR for SARS-CoV-2 detection. Clinical Microbiology and Infection, September. 26(9).
Cabrera Alvargonzalez, J. J. et. al., 2020. Pooling for SARS-CoV-2 control in care institutions. BMC Infectious Diseases, October. 20(745).
Chen, F. et. al., 2020. Comparing two sample pooling strategies for SARS-CoV-2 RNA detection for efficient screening of COVID-19. Journal of medical virology, October. Volumen 93.
Cherif, A., Grobe, N., Wang, X. & Kotanko, P., 2020. Simulation of Pool Testing to Identify Patients With Coronavirus Disease 2019 Under Conditions of Limited Test Availability. JAMA Network Open, June. 3(6).
Chong, B. S. et. al., 2020. Sample pooling is a viable strategy for SARS-CoV-2 detection in low-prevalence settings. Pathology, December. 52(7).
Deka S, K. D. M. A. S. R., 2020. Analysis of multi-sample pools in the detection of SARS-CoV-2 RNA for mass screening: An Indian perspective.. Indian Journal of Medical Microbiology, Volumen 38, pp. 451-6.
Deka, S. & Kalita, D., 2020. Effectiveness of Sample Pooling Strategies for SARS-CoV-2 Mass Screening by RT-PCR: A Scoping. Journal of Laboratory Physicians, 12(03).
Diagnostica, V. M., 2021. [Online] Available at: https://www.vitro.bio/Covid-19/Noticia/Diagnost/omicron
[Last access: 20 December 2021].
Farfan, M. J. et. al., 2020. Optimizing RT-PCR detection of SARS-CoV-2 for developing countries. Revista chilena de infectología, 37(3).
Gajanan D. Velhal, A. K. S. S. D., 2022. Contact Tracing for COVID-19 among Health-Care Workers of a Tertiary Care Hospital in Mumbai. Indian J Community Med., 47(3), pp. 420-424.
Gao, Z. et. al., 2021. A systematic review of asymptomatic infections with COVID-19. Journal of Microbiology, Immunology and Infection, February. 54(1).
García, Z. et. al., 1996. Evaluation of a pooling method for routine anti-HCV screening of blood donors to lower the cost burden on blood banks in countries under development. Journal of Medical Virology, July. 49(3).
Garg, A. et. al., 2020. Evaluation of seven commercial RT-PCR kits for COVID-19 testing in pooled clinical specimens. Journal of Medical Virology , November. 93(4).
Gupta, E. et. al., 2020. Pooled RNA sample reverse transcriptase real time PCR assay for SARS CoV-2 infection: A reliable, faster and economical method. PLoS One, 15(7).
Herrera, L. A. et. al., 2021. Saliva is a reliable and accessible source for the detection of SARS-CoV-2. International Journal of Infectious Diseases, April. Volumen 105.
Lagopati, N. et. al., 2021. Sample pooling strategies for SARS-CoV-2 detection. Journal of Virological Methods, March. Volumen 289.
Millioni, R. & Mortarino, C., 2020. Informed sequential pooling approach to detect SARS-CoV-2 infection. PLoS One, December. 15(12).
Mulu, A. et. al., 2021. Evaluation of sample pooling for screening of SARS CoV-2. PLoS One, February. 16(2).
National Center for Immunization and Respiratory Diseases (NCIRD) , 2021. [En línea]
Available at: https://www.cdc.gov/coronavirus/2019- [Last access: 30 June 2021].
Nishiura, H. et. al., 2020. Estimation of the asymptomatic ratio of novel coronavirus infections (COVID-19). International journal of Infection diseases, March. Volumen 94.
Pasomsub, E. et. al., 2020. Saliva sample pooling for the detection of SARS-CoV-2. Journal of Medical Virology, August. 93(3).
Roth, W. K., Weber, M. & Seifried, E., 1999. Feasibility and efficacy of routine PCR screening of blood donations for hepatitis C virus, hepatitis B virus, and HIV-1 in a blood-bank setting. The Lancet, January. 353(9150).
Schuetz, A. N. et. al., 2020. When Should Asymptomatic Persons Be Tested for COVID-19?. Journal of Clinical Microbiology, December.
Yelin, I. et. al., 2020. Evaluation of COVID-19 RT-qPCR test in multi-sample pools. Clinical Infectious Diseases, 71(16).
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.
La revista Biotecnia se encuentra bajo la licencia Atribución-NoComercial-CompartirIgual 4.0 Internacional (CC BY-NC-SA 4.0)













_(2).jpg)








