Bioacumulación, eliminación y efecto de endosulfán lactona en la concentración de ácidos grasos de Eisenia fétida
DOI:
https://doi.org/10.18633/biotecnia.v27.2358Palabras clave:
Vermicomposteo, plaguicidas, bioremediación, endusolfánResumen
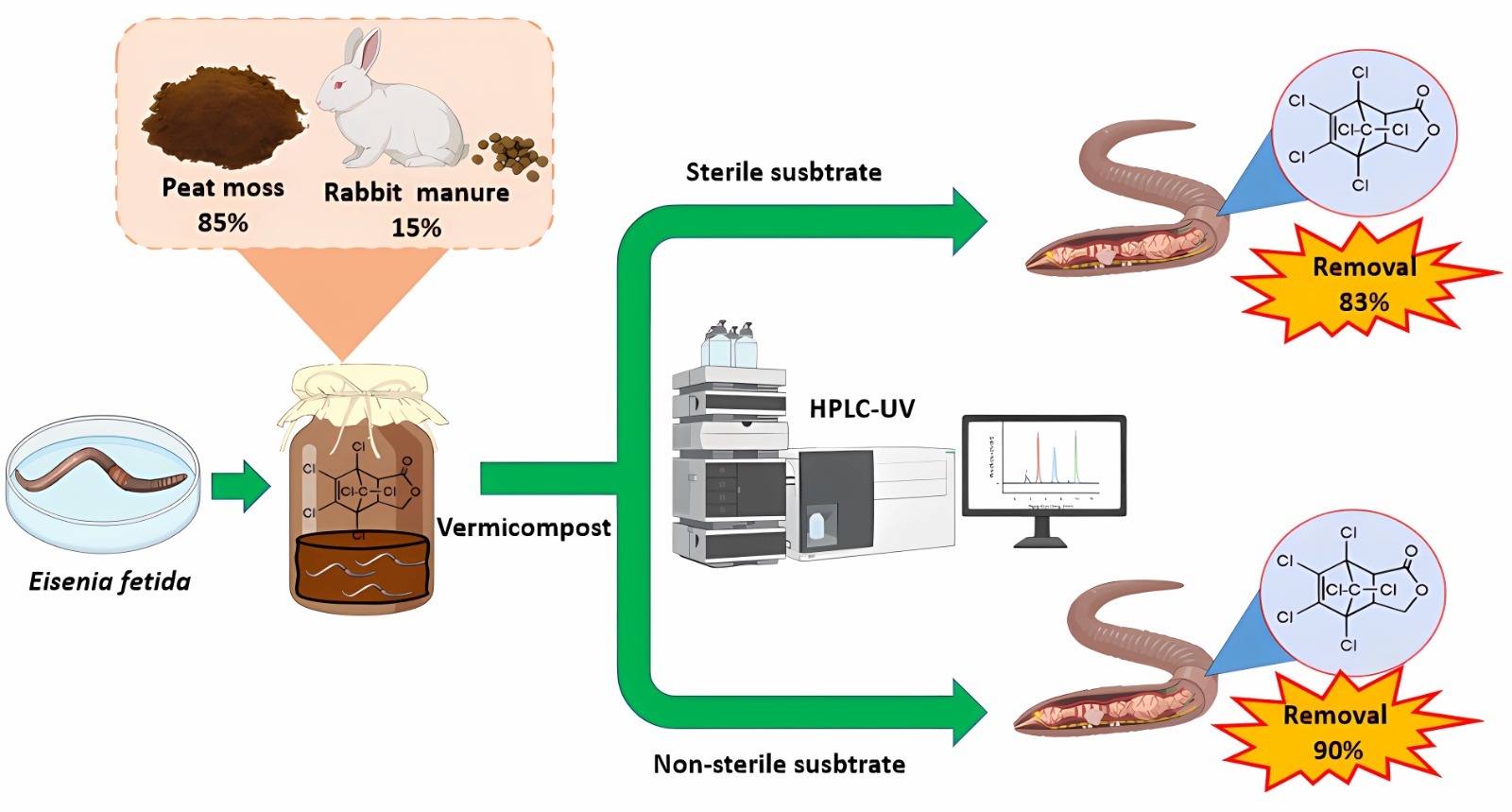
Las lombrices de tierra son organismos que tienen un papel importante en la ecología del suelo ya que establecen rela ciones mutualistas con los microorganismos para degradar la materia orgánica, generando compuestos menos complejos y más disponibles para ser utilizados como fuente de carbono. Esta simbiosis existente entre E. fetida y los microorganismos permite que, al estar presentes compuestos xenobióticos en el suelo, sean removidos, acumulados y/o eliminados. Endosulfán es un plaguicida que ha sido utilizado ampliamente y aunque tiene una vida media corta, genera derivados como endosulfán éter, endosulfán sulfato, endosulán lactona, entre otros. Algunos de ellos se han identificado en suelo agrícola por lo que Eisenia fetida se ve afectada en sus funciones por su presencia. Dichas afectaciones van desde deficiencias de crecimiento, hasta daño fisiológico y metabólico, ocasionando su muerte. En este estudio se evaluó el efecto de los microorganismos del sustrato en el incremento de peso, bioacumulación y eliminación de endosulfán lactona en E. fetida, a diferentes concentraciones (0.001, 0.004 y 0.009 mg kg-1), utilizando sustrato estéril y no estéril. Se observó 84% de incremento de peso de la lombriz con 0.004 mgkg-1 de endosulfán lactona, máxima acumulación (95 %), y eliminación (80 %) del plaguicida, en sustrato no estéril. El análisis estadístico multivariante demostró que la concentración de ácidos grasos presentes en E. fetida fue mayor en el sustrato no estéril, lo que evidencia la relación mutualista que existe entre la lombriz y los microorganismos presentes en el sistema.
En este estudio se evaluó el efecto de los microorganismos del sustrato en el incremento de peso, bioacumulación y eliminación de endosulfán lactona en E. fetida, a diferentes concentraciones (0.001, 0.004 y 0.009 mg kg-1), utilizando sustrato estéril y no estéril. Se observó 84% de incremento de peso de la lombriz con 0.004 mgkg-1 de endosulfán lactona, máxima acumulación (95 %), y eliminación (80 %) del plaguicida, en sustrato no estéril. El análisis estadístico multivariante demostró que la concentración de ácidos grasos presentes en E. fetida fue mayor en el sustrato no estéril, lo que evidencia la relación mutualista que existe entre la lombriz y los microorganismos presentes en el sistema.
Descargas
Citas
Ali M., Kazmi A., Ahmed N. (2014) Estudio sobre los efectos de la temperatura, la humedad y el pH en la cinética de degradación de aldrin, endosulfán y lindano durante el compostaje continuo a gran escala del tambor rotativo. Chemosphere, 102: 68-75.
ASTM 6584. Standard Test Method for Determination of Total Monoglycerides, Total Diglycerides, Total Triglycerides, and Free and Total Glycerin in B-100 Biodiesel Methyl Esters by Gas Chromatography
Astoviza M.J., Cappelletti N., Bilos C., Migoya M.C., Colombo J.C. (2016) Massive airborne endosulfan inputs related to intensive agriculture in Argentina's Pampa. Chemosphere. 144, 1459-1466. https://doi.org/10.1016/j.chemosphere.2015.10.033.
Cao J., Diao X., Hu J., Xie J., Du J., Zhao C. (2013) Effects of clomazone on antioxidative enzymes activity and DNA damage of earthworm. J. Agro. Environ. Sci. 32, 925–931.
Cao J., Li P., Li Q., Zheng P., Diao X. (2015) Bioaccumulation and elimination of the herbicide clomazone in the earthworms Eisenia fetida. Bull. Env. Cont. Toxicol. 95, 606-610. https://doi.org/10.1007/s00128-015-1649-7.
Chen T., Teng Y., Luo Y., Li X., Sun X., Li Z., Liu P. (2011) Potential for biodegradation of polychlorinated biphenyls (PCBs) by Sinorhizobium meliloti. J. Haz. Mat. 186, 1438-1444. https://doi.org/10.1016/j.jhazmat.2010.12.008.
Coutiño E., Hernández B., Gutiérrez R., Dendooven L. (2010) The earthworm Eisenia fetida accelerates the removal of anthracene and 9, 10-anthraquinone, the most abundant degradation product, in soil. Int. Biodeter. Biodegrad. 64, 525-529. https://doi.org/10.1016/j.ibiod.2010.05.002.
Curry J.P., Schmidt O. (2007) The feeding ecology of earthworms- A review. Pedobiologia. 50, 463-477. https://doi.org/10.1016/j.pedobi.2006.09.001.
Farenhorst A., Topp E., Bowman B.T., Tomlin A.D. (2000) Earthworm burrowing and feeding activity and the potential for atrazine transport by preferential flow. Soil Bio. Biochem.32,479-488. https://doi.org/10.1016/S0038-0717(99)00177-7
Givaudan N., Binet F., Le Bot B., Wiegand C. (2014) Earthworm tolerance to residual agricultural pesticide contamination: field and experimental assessment of detoxification capabilities. Environ. Pollut. 192, 9–18. http://doi.org./10.1016/j.envpol.2014.05.001.
Howell G.E., McDevitt E., Henein L., Mulligan C., Young D. (2018) Alterations in cellular lipid metabolism produce neutral lipid accumulation following exposure to the organochlorine compound trans‐nonachlor in rat primary hepatocytes. Env. Toxicol. 33 (9), 962-971. https://doi.org/10.1002/tox.22583.
Jayaraj R., Megha P., Sreedev P. (2016) Organochlorine pesticides, their toxic effects on living organisms and their fate in the environment. Interdisc. Toxicol. 9(3-4), 90–100. https://doi.org/10.1515/intox-2016-0012.
Kersanté A., Martin-Laurent F., Soulas G., Binet F. (2006) Interactions of earthworms with Atrazine-degrading bacteria in an agricultural soil. FEMS Microbiol. Ecol. 57, 192-205. https://doi.org/10.1111/j.1574-6941.2006.00108.x.
Lavelle P., Lattaud C., Trigo D., Barois I. (1995). Mutualism and biodiversity in soils Plant and Soil 170, 23-33. https://doi.org/10.1007/BF02183052.
Leesun K., Jin-Woo J., Ji-Young S., Chul-Su K., Jin Ye, H.J.K., Chang-Ho L., Seung-Man H., Sung-Deuk Ch. (2020) Nationwide levels and distribution of endosulfan in air, soil, water, and sediment in South Korea, Env. Poll., 265(Part B), 115035. https://doi.org/10.1016/j.envpol.2020.115035.
Li J., Sun H., Wang B., Hu G. (2004) Prediction of pyrene bioavailability in soil by earthworm (Eisenia fetida) bioaccumulation. J. Agr. Environ. Sci. 23, 1151-1155. https://doi.org/10.15640/jaes.
Lin D., Xie X., Zhou Q., & Liu Y. (2012) Biochemical and genotoxic effect of triclosan on earthworms (Eisenia fetida) using contact and soil tests. Environ. Toxicol. 27 (7), 385-392. https://doi.org/10.1002/tox.20651.
Lingling L., Yang D. , Song Y., Shi Y., Huang B., Bitsch A., Yan J. (2017) The potential acute and chronic toxicity of cyfluthrin on the soil model organism, Eisenia fetida. (2017). Ecotoxicol. Environ. Saf. 144, 456-463. http://doi.org/10.1016/j.ecoenv.2017.06.064.
Liu S., Zhou Q., Wang Y. (2018) Growth, reproduction and biochemical toxicity of chlorantraniliprole in soil on earthworms (Eisenia fetida). Chemosphere 150, 18–25. http://doi.org/10.1016/j.ecoenv.2017.12.010.
Mehdi M.M., Layqat M., Majid S. (2020) Biomolecular alterations by chronic sub-lethal exposure of malathion and paraquat in Drosophila melanogaster: study on pesticide tolerance in insects. Int. J Trop. Insect. Sci. 40, 869–876 https://doi.org/10.1007/s42690-020-00143-6.
Mosleh Y., Paris S., Couderchet M., Verne G. (2003) Effects of the herbicide isoproturon on survival growth rate, and protein content of mature earthworms (Lumbricus terrestris L.) and its fate in the soil. Appl. Soil Ecol. 23, 69–77. https://doi.org/10.1155/2010/678360.
Mudiam R., Ratnasekhar C., Saxena N. (2013) Gas chromatography mass spectrometry based metabolomic approach for optimization and toxicity evaluation of earthworm sub-lethal responses to carbofuran. PLoS One 8, e81077. https://doi.org/10.1371/journal.pone.0081077.
OECD (1984), Test No. 207: Earthworm, Acute Toxicity Tests, OECD Guidelines for the Testing of Chemicals, Section 2, OECD Publishing, Paris, https://doi.org/10.1787/9789264070042-en.
Odukkathil G., Vasudevan N. (2016) Residues of endosulfan in surface and subsurface agricultural soil and its bioremediation. J. Environ. Manag. 165: 72-80. https://doi.org/10.1016/j.jenvman.2015.09.020.
Oliveira J.M., Brinati A., Miranda L.D.L., Morais D.B., Zanuncio J.C., Gonçalves R.V., Peluzio M.C., Gouveia M.B. (2017) Exposure to the insecticide endosulfan induces liver morphology alterations and oxidative stress in fruit‐eating bats (Artibeus lituratus). Int. J. Exp. Path. 98 (1),17-25. https://doi.org/10.1111/iep.12223.
Organization for Economic Cooperation and Development. (1984) Earthworms acute toxicity test. In Guideline for Testing of Chemicals 207. Paris, France.
Owagboriaye F., Dedekeb G., Bamideleb J., Aladesidab A., Isiborc P., Feyisolad R., Adelekea M. (2020) Biochemical response and vermiremediation assessment of three earthworm species (Alma millsoni, Eudrilus eugeniae and Libyodrilus violaceus) in soil contaminated with a glyphosate-based herbicide. Ecol. Indic. 108, 105678. https://doi.org/10.1016/j.ecolind.2019.105678.
Peñaloza G.S.A., Rincón D.J.P., Restrepo L.G.C. (2013) Evaluación de la esterilización húmeda y la esterilización por microondas de dos tipos de suelos. Revista científica. 1 (17), 87-93. https://doi.org/10.14483/23448350.4567.
Silva M.H., Beauvais S.L. (2010) Human health risk assessment of endosulfan. I: Toxicology and hazard identification. Reg. Toxicol. Pharmacol. 56: 4-17. https://doi.org/10.1016/j.yrtph.2009.08.013.
Singh S.I., Singh S., Bhawana A.P. (2020) Chapter 13 - Earthworm-assisted bioremediation of agrochemicals. In, Prasad MNV, editor. Agrochemicals Detection, Treatment and Remediation. Butterworth-Heinemann. 307-327.
Sun Y., Zhao L., Li X., Hao Y., Xu H., Weng L., Li Y. (2019) Stimulation of earthworms (Eisenia fetida) on soil microbial communities to promote metolachlor degradation. Environ. Pollut. 248, 219-228. https://doi.org/10.1016/j.envpol.2019.01.058.
Sun Y., Diao X., Zhang Q., Shen J. (2005) Bioaccumulation and elimination of avermectin B1a in the earthworms (Eisenia fetida). Chemosphere 60, 699–704. https://doi.org/10.1016/j.chemosphere.2005.01.044.
Thangadurai P., Suresh S. (2014) Biodegradation of endosulfan by soil bacterial cultures. Int. Biodet. Biodeg., 94, 38-47. https://doi.org/10.1016/j.ibiod.2014.06.017.
Tiwari M.K., Guha S. (2013) Kinetics of the biodegradation pathway of endosulfan in the aerobic and anaerobic environments. Chemosphere 93, 567-573. https://doi.org/10.1016/j.chemosphere.2013.07.005.
Uchendu C., Ambali S.F., Ayo J.O., Esievo K.A.N. (2018) Chronic co-exposure to chlorpyrifos and deltamethrin pesticides induces alterations in serum lipids and oxidative stress in Wistar rats: mitigating role of alpha-lipoic acid. Env. Sci. Poll. Res. Int. 25 (20) 19605-19611. https://doi.org/10.36632/csi/2019.8.4.9.
Vázquez-Villegas P.T., Meza-Gordillo R., Luján-Hidalgo M.C., Cruz-Salomón A., Ruíz-Valdiviezo V.M., Gutiérrez-Miceli F.A., Villalobos-Maldonado J.J., Montes-Molina J.A. (2021) Optimization and validation of an extraction method for endosulfan lactone on a solid substrate. Processes. 9,284. https://doi.org/10.3390/pr9020284.
Vázquez P., Meza R., Gutiérrez F., Ruíz V., Villalobos J., Montes J., Fernández A. (2018) Determinación de CL50 y CE50 de endosulfán lactona y diazinón en lombriz de tierra (Eisenia foetida). Agroproductividad, 11 (4). Recuperado a partir de https://revista-agroproductividad.org/index.php/agroproductividad/article/view/277.
Villalobos-Maldonado J.J., Meza-Gordillo R., Mancilla-Margalli N.A., Ayora-Talavera T.R., Rodríguez-Mendiola M.A., Arias-Castro C., Vázquez-Villegas P.T., Ruíz-Valdiviezo V.M. (2015) Removal of decachlorobiphenyl in vermicomposting process amended with rabbit manure and peat moss. Water, Air, & Soil Poll., 226 (5), 1-11. https://doi.org/10.1007/s11270-015-2400-z.
Wang F., Ji R., Jiang Z., Chen W. (2014) Species-dependent effects of biochar amendment on bioaccumulation of atrazine in earthworms. Environ. Pollut. 186, 241-7. http://doi.org/10.1016/j.envpol.2013.12.012.
Wijesiri B., Liu A., Jayarathne A., Duodu G., Ayoko D., Chen L., Goonetilleke A. (2021) Influence of the hierarchical structure of land use on metals, nutrients and organochlorine pesticides in urban river sediment. Ecol. Eng. 159, 106123. https://doi.org/10.1016/j.ecoleng.2020.106123.
Xiang D., Chu T., Li M., Wang Q., Zhu, G. (2018) Effects of pyrethroid pesticide cis-bifenthrin on lipogenesis in hepatic cell line. Chemosphere 201, 840-849. https:// 10.1016/j.chemosphere.2018.03.009.
Yajuan S., Xiangbo X., Chen J., Ruoyu L., Xiaoqi Z., Yajing S., Yurong W. (2018) Antioxidant gene expression and metabolic responses of earthworms (Eisenia fetida) after exposure to various concentrations of hexabromocyclododecane. Environ. Pollut. 232, 2457-251. http://doi.org/10.1016/j.envpol.2017.09.039.
Ye X., Xiong K., Liu J. (2016) Comparative toxicity and bioaccumulation of fenvalerate and esfenvalerate to earthworm Eisenia fetida. J. Hazard. Mater. 310, 82–88. http://doi.org/10.1016/j.jhazmat.2016.02.010.
Zeb A., Li S., Wu J., Lian J., Liu W., Yuebing S. (2020) Insights into the mechanisms underlying the remediation potential of earthworms in contaminated soil: A critical review of research progress and prospects. Sci. Total Env. 740, 140145. https://doi.org/10.1016/j.scitotenv.2020.140145.
Zhang B., Pan X., Cobb G., Anderson T. (2009) Uptake, bioaccumulation, and biodegradation of hexahydro-1, 3, 5-trinitro-1, 3, 5-triazine (RDX) and its reduced metabolites (MNX and TNX) by the earthworm (Eisenia fetida). Chemosphere 76:76–82.
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.
La revista Biotecnia se encuentra bajo la licencia Atribución-NoComercial-CompartirIgual 4.0 Internacional (CC BY-NC-SA 4.0)













_(2).jpg)








